塑料为人们的生活带来了许多便利,但其给环境带来的危害也是亟待解决的难题。如今,塑料污染物又増一员——微塑料,它甚至可以进入人体,对身体健康“环境”产生影响。
微塑料是什么,如何应对这一健康新威胁?本文将从线虫模型下对微塑料毒性的研究里一探究竟。


微塑料是指小于5mm的塑料颗粒,是污染的主要载体。2022年3月,科学家首次在人体血液中检测到了微塑料污染,引起了人们对健康的担忧。
据研究,每周约有2000个微塑料颗粒 (约5克) 会与普通水和食物一起进入体内。随着研究的进行,它们从视觉识别到机器传感器识别,尺寸变得越来越小,按粒径范围可分为微米塑料 (1μm-5mm)、亚微米塑料 (100nm-1μm) 和肉眼通常不可见的纳米塑料 (<100nm)。

尽管目前还没有分离纳米塑料的方法,但已在实验室实验中证明了纳米塑料碎片的存在,大多数研究人员认为它们同样存在于环境中。与普通微塑料不同,纳米塑料足够小,通过口腔进入肠道后,可以在血流和细胞膜中积聚,甚至可以越过血脑屏障,进一步造成神经损伤和生殖异常。
不过也有研究表明,肠道菌群可与纳米材料诱导的各种生物效应相互作用,如氧化应激、炎症、肠道功能障碍,从而影响纳米材料的毒性。
如今,粪菌移植 (FMT) 已被广泛接受为是一种可以重建健康的肠道菌群,实现对炎症性肠病、便秘、糖尿病、肝性脑病、脂肪肝、慢性乙肝、肠易激综合征和抗生素相关性腹泻等肠外疾病治疗的方法。
至于纳米塑料的毒性,研究人员发现,肠道微生物区系的改变是食源性二氧化钛纳米颗粒对肥胖和非肥胖小鼠产生不良影响的新机制。同时,食源性二氧化钛纳米颗粒对肥胖小鼠的不良反应比非肥胖小鼠更强,这与肥胖小鼠的肠道微生物区系失调高度相关,表明肠道微生物区系在防止纳米颗粒诱导的毒性方面具有潜在的保护作用。
然而,到目前为止还没有关于肠道菌群与纳米塑料毒性之间关系的研究。秀丽隐杆线虫 (以下简称线虫) 作为一种典型的毒理学评价模型,与人类基因具有一定相似度、全身透明易于观察,适合基于纳米塑料的累积特性来评价其毒性。此外,实验室培养的线虫具有完整的肠道系统和单一的肠道菌群 (大肠杆菌E.coli),这使得它们适合通过FMT来模拟更高等动物的肠道系统。
基于上述背景,科研人员推测FMT可能有助于预防纳米塑料诱导的线虫毒性,并试图寻找其与纳米塑料诱导线虫毒性之间的潜在关系。

近期,一篇论文以线虫为研究对象,对纳米塑料的分布、转移、蓄积和毒性进行了系统评价,并首次应用线虫作为FMT的模型进行了创新性探索:
Fecal microbiota transplantation attenuates nano-plastics induced toxicity in Caenorhabditis elegans
(FMT减弱纳米塑料对线虫的毒性)

研究结果显示:通过口服,纳米塑料可在线虫肠道内迅速蓄积,并进一步穿过肠道屏障到达全身,从而导致线虫运动行为减少,出现氧化应激、甚至死亡;而在FMT后,线虫对纳米塑料的毒性表现出更好的抵抗力。
这表明肠道微生物群可以帮助抵抗纳米塑料的毒性;与科研人员最初的假设“FMT可以减轻纳米塑料的毒性”是一致的。

长期毒性
研究人员使用聚苯乙烯纳米塑料模拟生态环境中的塑料污染,通过长时间和急性两种方式处理线虫,并进行相应的毒理学评价。
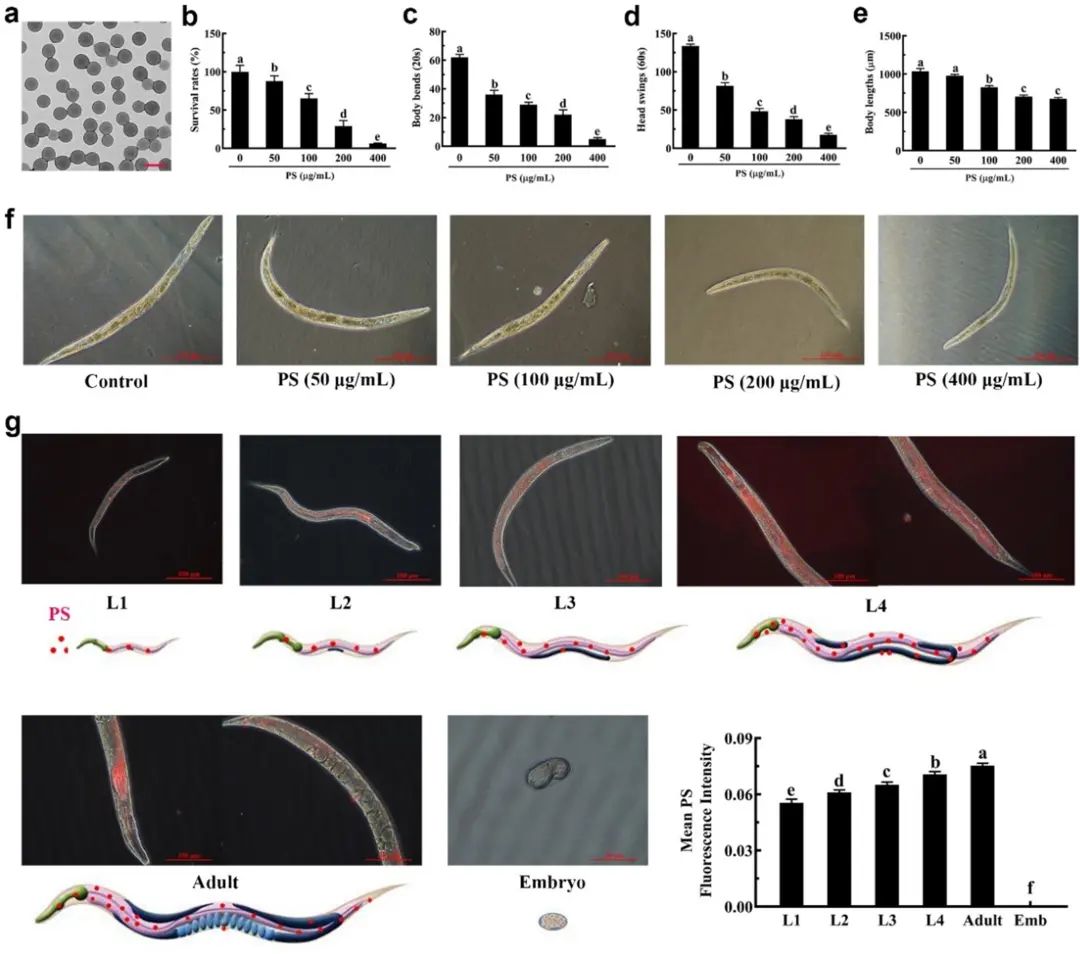
图1
如图1b-f所示,观察和检测记录发现,线虫成长期 (L1期幼虫到成虫,共持续5天) 暴露在不同浓度纳米塑料 (50~400 μg/mL) 中,其存活率、身体长度、运动状态均随浓度增加而降低,表现出较明显的剂量依赖性,表明纳米塑料对线虫造成了毒性损伤。
红色荧光标记的聚苯乙烯纳米颗粒 (100μg/mL) 可以帮助科研人员观察到纳米塑料在虫体内的累积情况。随着线虫在含有纳米塑料的培养液中的时间增加,虫体荧光强度进一步增强。有趣的是,在胚胎中无法检测到纳米塑料 (图1g)。这或许与线虫的生殖系统保护有关,可以期待之后进一步的研究。
急性损伤毒性
研究人员接着测试了不同浓度 (50~400 μg/mL) 纳米塑料对线虫的急性损伤,线虫在纳米塑料中的暴露时间为24h。
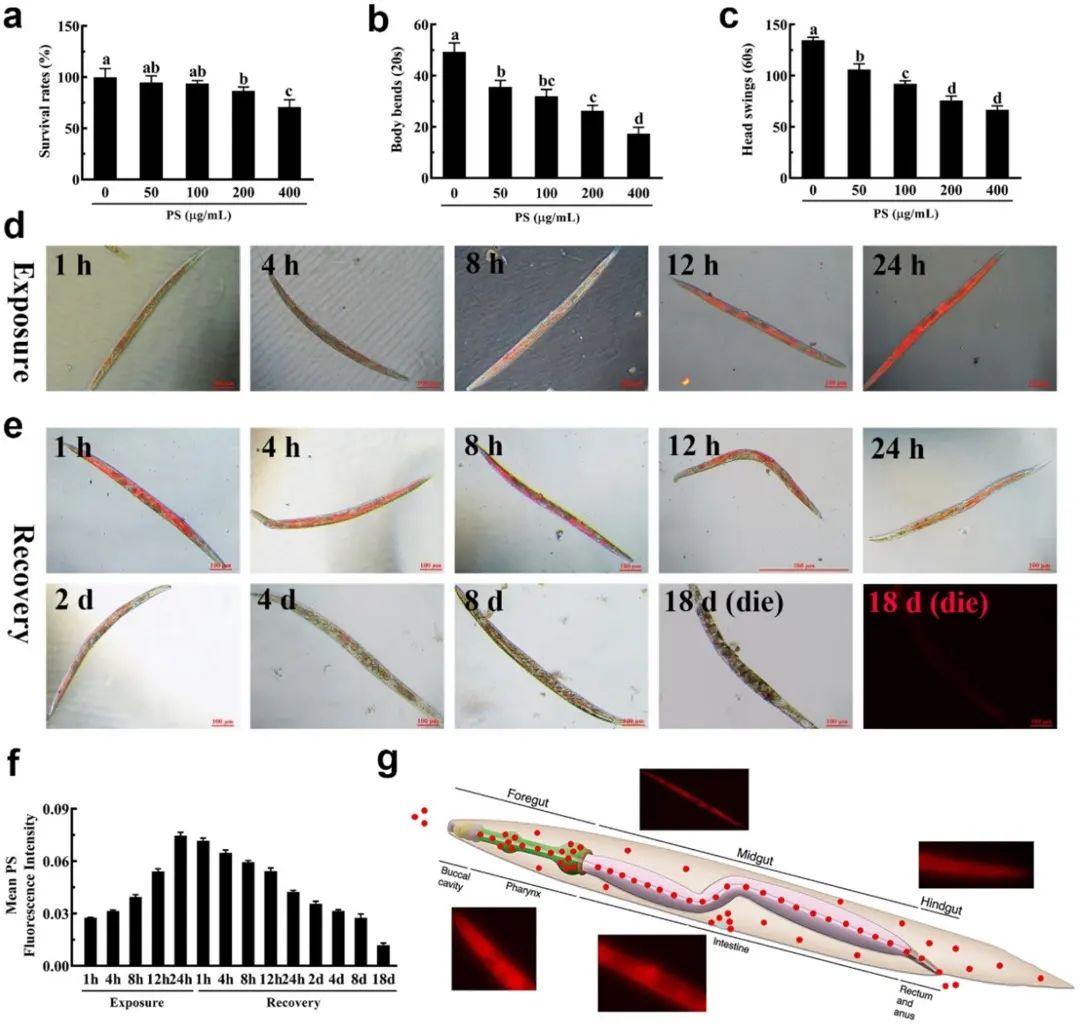
图2
实验结果与长时间相似,随着纳米塑料浓度的增加,线虫表现出存活率降低和运动行为显著减弱 (图2a-c)。并且,随着暴露时间的延长,纳米塑料在蠕虫体内的吸收和积累也增强。
24h后,高强度的红色荧光充满全身,说明纳米塑料持续被线虫吸收到体内,并越过肠道屏障到达全身,最后导致了存活率和运动行为的下降,但明显看出咽部和生殖道的积累比其他器官多 (图2d, g)。在不同时间的恢复后,可以发现红色荧光明显下降,直到死亡依然能检测到荧光,说明纳米塑料一旦摄取不能完全释放,会导致持续毒性。
氧化还原状态
文章接下来研究了纳米塑料对N2线虫的氧化还原失衡的影响,为了阐明纳米塑料诱导线虫体内的氧化应激的机制,研究人员测定了暴露24小时后线虫的氧化应激和恢复反应。
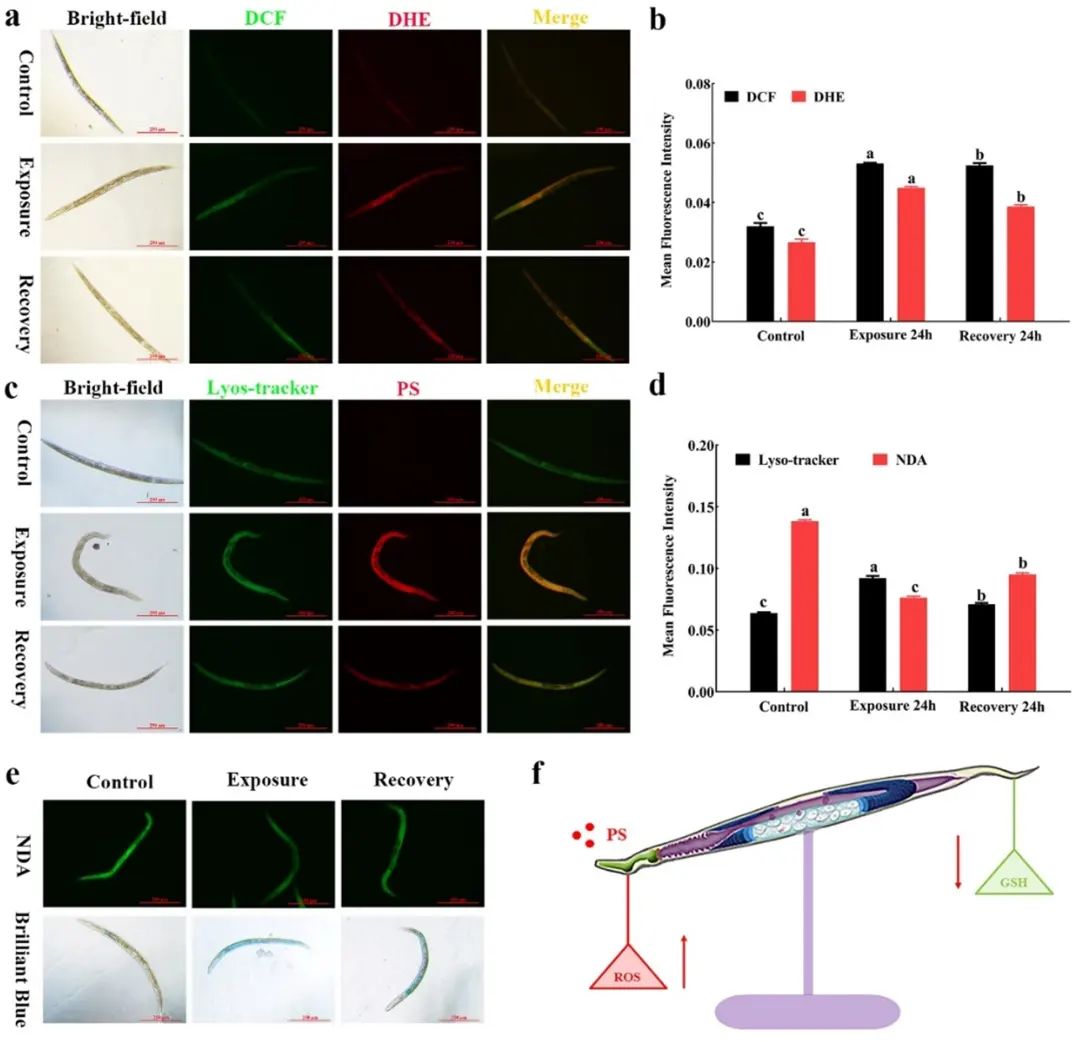
图3
结果发现,纳米塑料使得线虫的活性氧 (ROS) 和氧离子 (O2-) 的积累增加,转移至正常状态24小时后,线虫的氧化应激得到了适度恢复 (图3a);而在暴露后,纳米塑料和溶酶体的共定位 (图3c中的黄色荧光) 增强了,转移至正常状态后减少。
随着纳米塑料穿过肠道屏障进入全身并内化到溶酶体中,肠道的氧化还原平衡和通透性发生了变化,肠道通透性增加,谷胱甘肽含量下降。
表明纳米塑料通过咽部转移到肠道系统,进而进入线虫全身,增加了肠道通透性,并通过ROS的过度产生和谷胱甘肽的过度消耗扰乱了细胞内氧化还原平衡,从而导致线虫体内的氧化还原失衡。
FMT的保护作用
为探究FMT对纳米塑料诱导毒性的保护作用,研究人员将线虫暴露于低剂量纳米塑料15天。
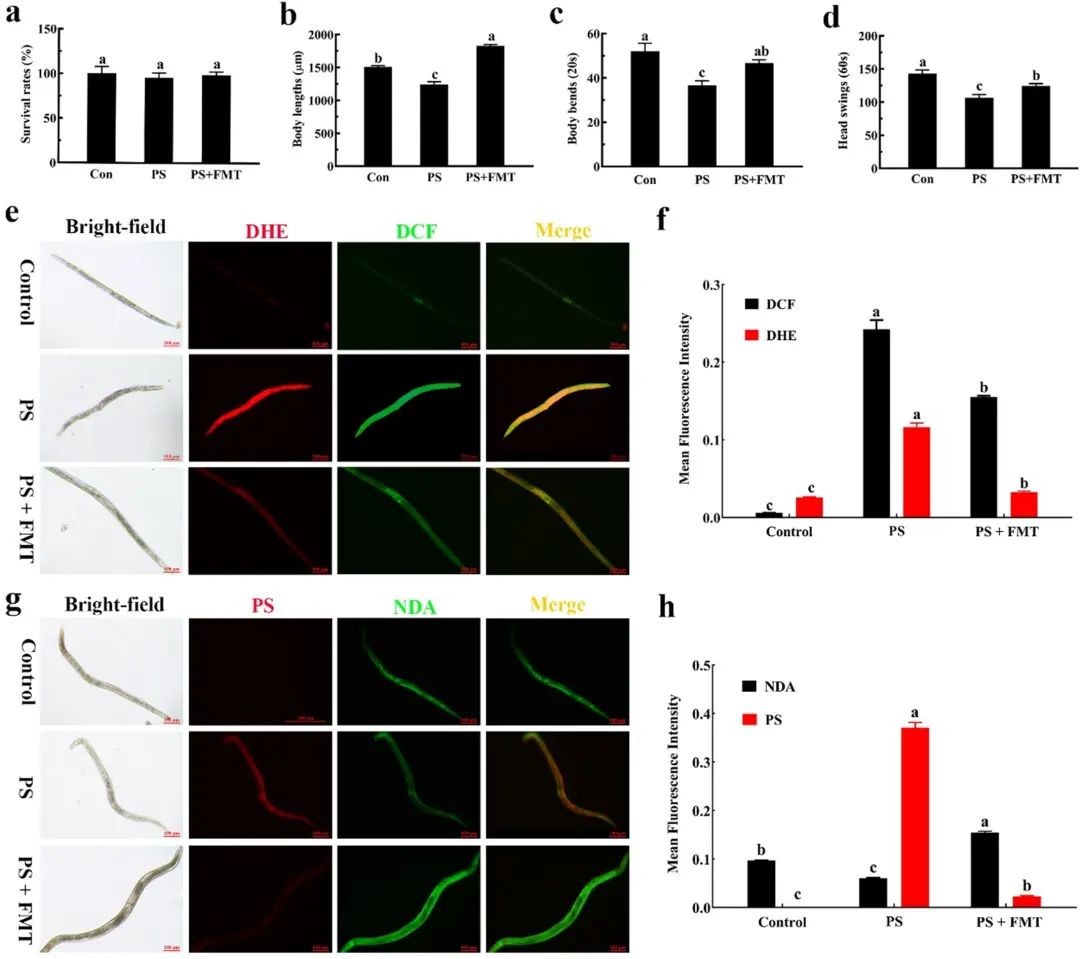
图4
结果显示,FMT和纳米塑料组的存活率均未明显下降 (图4a)。不过,纳米塑料显著抑制了线虫的身体长度和运动行为,而FMT逆转了这种下降趋势 (图4b-d)。
同时,FMT还能降低纳米塑料诱导的过量ROS和O2-的积累 (图4e, f)。此外,随着红色荧光强度的下降,FMT缓解了纳米塑料在线虫体内的积累 (图4g, h) 结合以上结果,可以证明FMT可以显著改善暴露在纳米塑料下线虫的生存状态,但其机制尚不明确。
FMT与谷胱甘肽生成
在秀丽隐杆线虫中,daf-2和daf-16基因通常被认为是氧化应激和衰老期间最重要的转录因子,而实验发现,对于基因有daf-2和daf-16的突变体线虫,FMT仍可以减轻纳米塑料诱导的毒性。
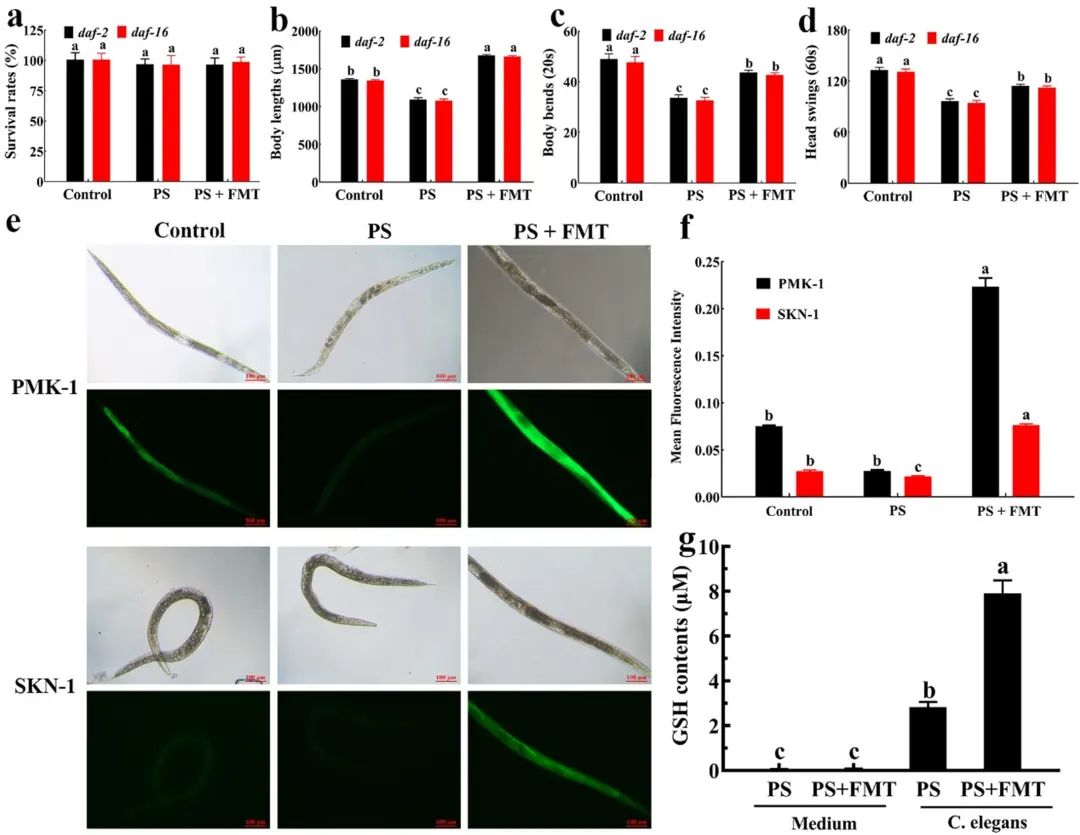
(图5 FMT通过PMK-1/SKN-1途径加速谷胱甘肽生成减轻纳米塑料诱导的线虫毒性)
如图5a-d,移植FMT后线虫体长、身体弯曲次数、头部摆动次数均有显著增加,与普通野生型线虫无明显区别。这表明了daf-2和daf-16基因不参与FMT的保护过程。而由前文可知,暴露于纳米塑料的线虫移植了FMT后,谷胱甘肽得到了显著提高,因此猜想FMT可能通过产生丰富的谷胱甘肽来防御氧化应激,而不是通过调节daf-2和daf-16基因。
而在秀丽隐杆线虫中,激活PMK-1 (与人类的p38同源)/SKN-1 (Nrf2直系同源) 途径可以增强谷胱甘肽合成酶的表达水平,从而诱导谷胱甘肽的过度产生。为了验证假设,实验引入了PMK-1和SKN-1相关基因。结果表明,FMT可以显著改变纳米塑料诱导的PMK-1和SKN-1表达水平的下降 (图5e, f)。
同时,科研人员还测定了单独的培养基和线虫中谷胱甘肽的含量。与单独处理的暴露后的线虫相比,移植FMT后谷胱甘肽含量显着增加 (约3倍),在培养基中几乎未检测到谷胱甘肽 (图6g),这表明高含量的谷胱甘肽是由线虫而不是微生物群产生的,由此证明FMT是通过PMK-1/SKN-1途径加速谷胱甘肽生成,从而减轻纳米塑料诱导的线虫毒性。
FMT的保护作用验证
为进一步验证FMT的保护作用是由谷胱甘肽在起作用,科研人员通过添加谷胱甘肽合成酶抑制剂BSO阻断谷胱甘肽的合成。
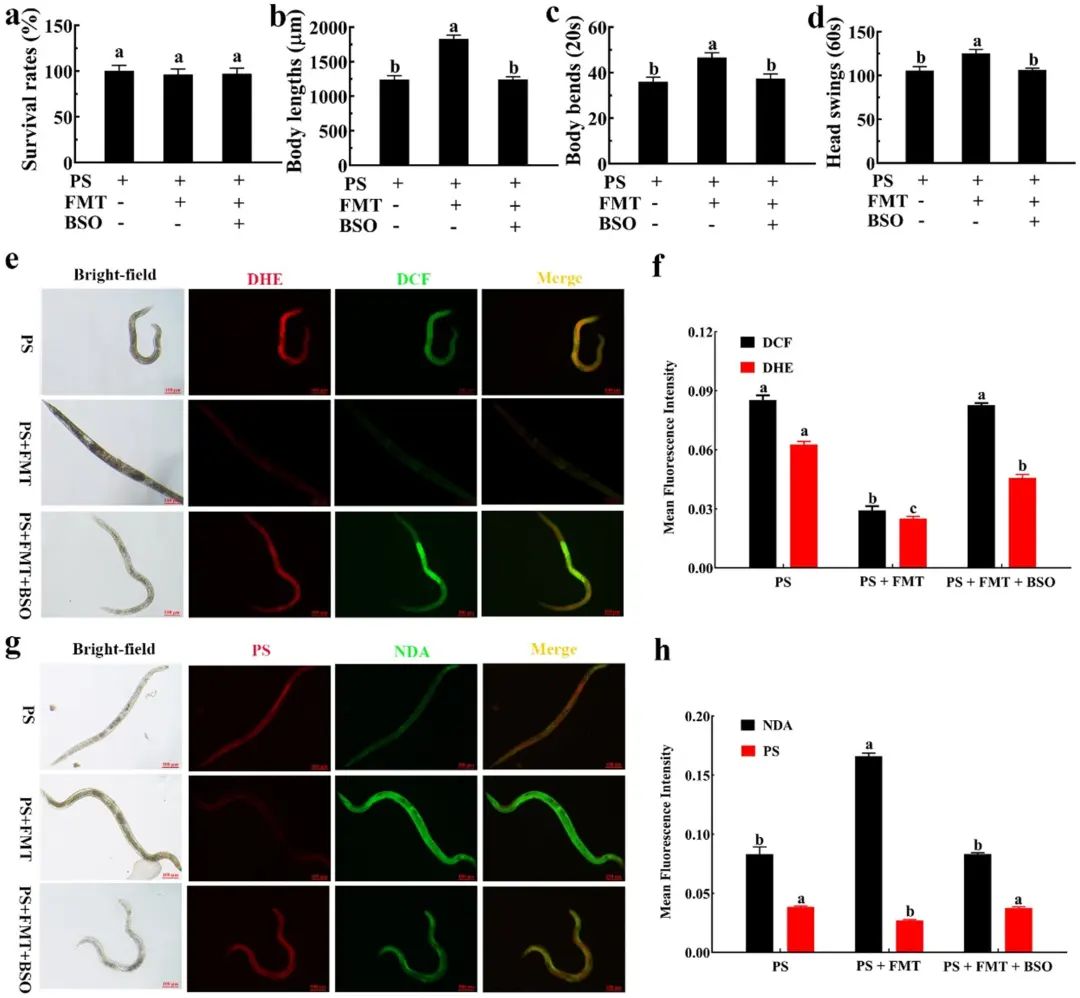
图6
结果发现:添加BSO后,FMT对纳米塑料诱导的发育迟缓 (图6b) 和运动行为减少 (图6c和d) 的保护作用消失了。同时,在BSO条件下,FMT维持的氧化还原稳态也随着纳米塑料、ROS和O2−的积累和谷胱甘肽的消耗而被破坏了 (图6e-h)。
综合上述内容,科研人员发现BSO通过抑制线虫体内谷胱甘肽的生成,显著抑制了FMT启动的纳米塑料保护作用,这也提示FMT可以激活PMK-1/SKN-1通路,提高谷胱甘肽合成酶的表达水平。
外源性谷胱甘肽保护作用
上述结果表明,内源性谷胱甘肽能够保护机体免受纳米塑料的伤害,那么外源性谷胱甘肽的加入是否也能减弱其毒性?
为此,科研人员在培养基中添加外源谷胱甘肽,研究其对急性和长期接触纳米塑料的线虫保护作用。
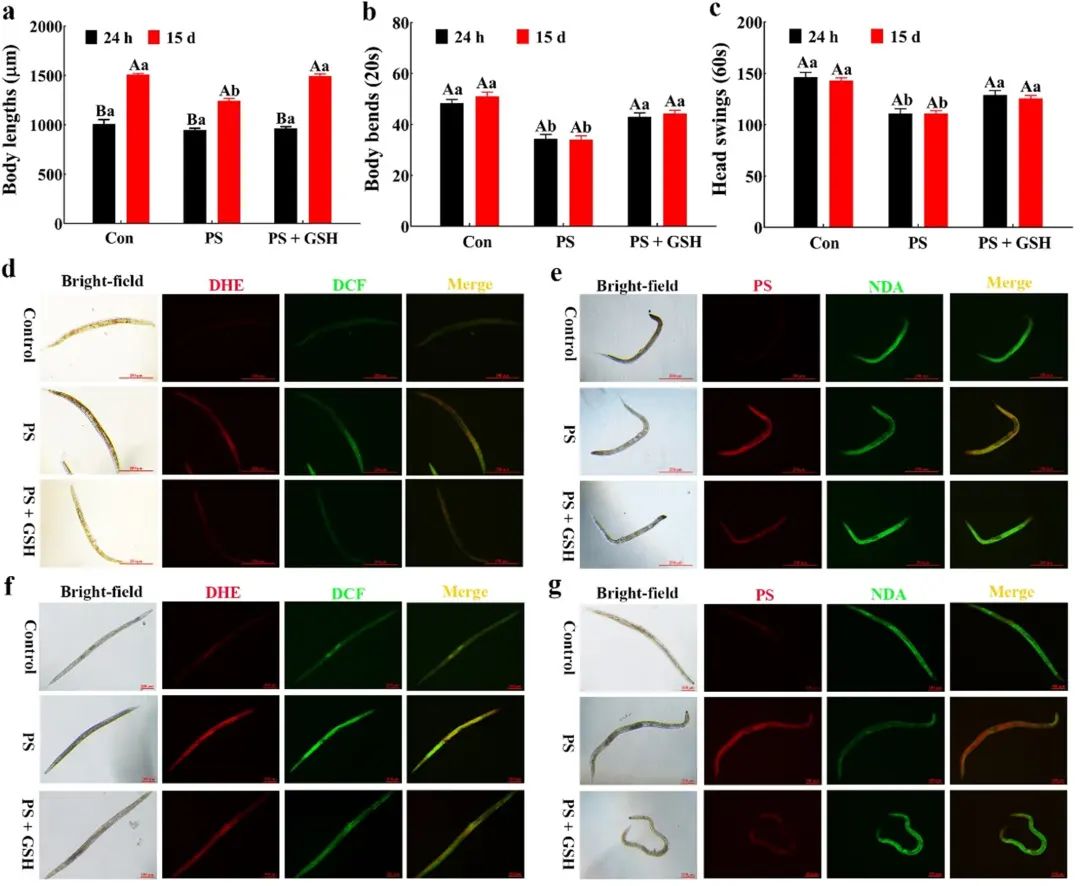
图7
正如预期的那样,外源性谷胱甘肽在暴露15天后明显增加了线虫体长 (图7a) 和运动行为 (图7b, c)。同时,在急性 (图7d, e) 和长时间 (图7f, g) 暴露下,平均DCF (图7d, f中的绿色荧光)、DHE (图7d, f中的红色荧光) 和纳米塑料 (78e, g中的红色荧光) 荧光强度的显著降低,平均NDA荧光强度的显著增加 (图7e, g中的绿色荧光),表明外源性谷胱甘肽对纳米塑料诱导的氧化损伤都有保护作用。
以上结果共同表明,添加外源谷胱甘肽也是缓解纳米塑料诱导毒性的重要途径。

微塑料对人体健康的主要威胁在于其分布广泛且微小,在通过胃肠道系统后,如分解成更小的纳米级塑料,可能会与肠道微生物相互作用,并穿过肠道屏障到达全身,而纳米塑料在体内的分布和积累对健康的影响仍亟待研究。
该研究利用荧光标记的纳米塑料,可视化研究了其在线虫体内的转移和分布特性,为进一步的毒理学研究奠定基础,并为基于生物分布的纳米颗粒毒理学评价提供参考。
与此同时,大量研究表明,肠道微生物在维持机体功能方面发挥着关键作用,而目前的大多数研究忽略了消化过程和肠道微生物的作用。该研究也发现,不仅粪菌移植 (FMT) 可以激活机体产生大量谷胱甘肽来抵抗纳米塑料诱导的毒性,外源添加谷胱甘肽也有助于抵抗毒性。而更多数据表明,微塑料对更高等生物的影响可能低于现有的体外模型评估结果,因为肠道中的微生物会发挥保护作用,尽管这还需要在哺乳动物上进一步验证;此外,还可以通过补充外源性谷胱甘肽来对抗微塑料带来的健康风险。
因此,本次研究的结果将有助于我们充分了解纳米塑料对线虫的毒性及其对机体健康的潜在风险,为抵御其毒性提供新的探索方向。我们也相信,未来会有更多更深入的发掘,在现有研究的基础上,将秀丽隐杆线虫和肠道菌群引入纳米材料毒性净化领域;基于该研究方法和模型的宝贵经验,为肠道菌群移植的研究打开新的思路。(供稿 完美生科院微信公众号)
责编:樊汝琴
一审:樊汝琴
二审:喻志科
三审:熊佳斌
来源:新湖南客户端

 湖南日报新媒体
湖南日报新媒体


